发布日期:2024-09-05 09:51 点击次数:61

研发濒临进入大、风险高级问题 国产改进药何时不再跟跑哥哥啪
本年以来,国产改进药发展迅猛,险些每隔一两个月就有一个新药获批上市。但与阐扬国度比较,我国新药研发仍有较大差距。针对改进药盘问周期长、进入大、风险高、临床盘问资源清寒等问题,我国将实施药品专利贯穿和专利期限赔偿轨制,为新药研发营造细密计策环境
一直以来,要紧疾病患者招架癌药物可及、药价下落、新药上市的贫瘠期盼从未消减。为得志雄伟民众迫切用药需求,频年来,我国出台了多项计策饱读吹和加速国表里抗癌药、改进药上市。在高价原研药与廉价仿制药的两难之间,国产改进药被视为是治理问题的最好决策。
“本年以来,险些每隔一两个月就有一个我国自主研发的新药获批上市,呈现出一种前所未有的荟萃爆发态势。”“要紧新药创制”国度科技要紧专项时间副总师、中国科学院院士陈凯先暗示,尽管国产改进药发展迅猛,但与阐扬国度先进水平比较,我国新药研发仍有较大差距,我国咫尺绝大部分改进药物照旧在国际发现的作用机制、作用靶点基础上研发出来的。国产改进药何时能脱离“跟跑”的近况成为业内柔和的话题。
入口药加速落地
近期,国度医疗保障局将瑞戈非尼、打针用阿扎胞苷等17种经过接头的抗癌药纳入《国度基本医疗保障、工伤保障和生养保障药品目次(2017年版)》乙类规模,药品价钱平均降幅达到56%,最高的达到70%。为了让雄伟参保东谈主员实时享受本次国度药品接头降价的利好新政,北京、江西等省市纷繁按照国度端正,明确了限定支付规模、医保支付标准和灵验期。
以颐养直肠癌的靶向药“西妥昔单抗(爱必妥)”为例,国度接头前个东谈主年均医药费近24万元,接头后个东谈主年均医药费约10万元,北京市将其纳初学诊迥殊病报销后,城镇员工个东谈主年均劳动将进一步裁汰到2万元傍边,大大减弱了患者的医疗用度劳动。
与此同期,境外上市新药在国内加速落地。“频年来,我国对境外上市新药的审批速率较着提高。”国度药品监督不息局局长焦红先容,近10年来,在好意思国、欧盟、日本上市的新药有415个,这些新药中哥哥啪,已在我国上市或文牍的新药有277个,占66.7%。从审批数目看,近5年平均每年批准入口药品临床推行336件,每年递加7%;平均每年批准入口药品上市56件,每年递加16%;从临床审批和上市审批的总时限看,我国新药审批法定时限与阐扬国度接近。
为了让雄伟患者尽早用上境外上市新药,从本年4月12日于今,国度药监局针对国内临床需求,科学简化审批经过,加速临床急需的境外上市新药审评审批劳动,共批准7个防治严重危及人命疾病的境外新药上市。比如,驻扎宫颈癌的九价HPV疫苗、颐养丙肝的第三代居品索磷布韦维帕他韦片。
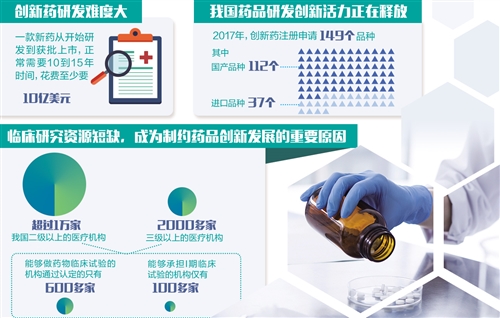
尽管入口药来势汹汹,但原土医药企业的改进积极性依然很高。“跟着药品审批轨制更正的潜入鞭策,国内药品研发改进活力得到积极开释,扶优汰劣的效果正在显现。”国度药品监督不息局药品化妆品注册不息司司长王立丰先容,药品审批轨制更正实施以来,新药文牍占比逐步进步,以化学药为例,2017年改进药注册肯求149个品种,其中112个国居品种、37个入口品种,较2016年增长了66%,研发改进活力进一步开释。
新药研发难度大
改进药指含有新结构的化合物,且具有临床价值,主要为国度Ⅰ类新药。据统计,本年数十种获批上市的国产Ⅰ类新药中,莫得一个靶点是自主发现的。“靶点是新药研发的基础,我国改进药真要有所冲突,就要从靶点的发现作念起。”中国科学院院士、四川大学老师魏于全说。
什么是靶点?南京外传生物科技公司首席科学官范晓虎先容,药物与体内生物大分子的联结部位即药物靶点。药物作用靶点不错是受体、酶、离子通谈、转运体、免疫系统、基因等,其发现和考证是一个相等复杂的过程。“就像一把锁,要找到与之匹配的一把钥匙,钥匙仅仅插进去还不能,还要能旋转,在此基础上合成的小分子化合物才略对疾病灵验。”
改进药研发难度之大远不啻于此,新药盘问周期长、进入大、风险高级问题也让不少药企望而生畏。据业内东谈主士流露,一款新药从开动研发到获批上市,必须要经过体外,临床前动物,临床Ⅰ、Ⅱ、Ⅲ期等一系列盘问,10到15年是很宽泛的时辰,浪掷至少要10亿好意思元。
临床盘问资源清寒,亦然制约我国药品改进发展的弱点原因。数据傲气,我国二级以上的医疗机构仍是跳跃1万家,三级以上的医疗机构有2000多家,可是当今能作念药物临床推行的机构通过认定的只须600多家,大约承担I期临床推行的机构仅有100多家,这在某种程度上成为医药改进的瓶颈。由于临床机构还承担着大宗的医疗任务,怎样从平分离出一部分来承担药物临床推行,显得尤为弱点。
2017年10月,中共中央办公厅和国务院办公厅纠合印发的《对于深化审评审批轨制更正饱读吹药品医疗器械改进的概念》明确建议,将临床推行机构资历认定改为备案不息,赞成临床推行机构和东谈主员开展临床推行。“在医疗机构和大夫紧缺的配景下,将临床推行机构资历认定改为备案制,不错减少中间局势,有助于提高临床推行盘问者的积极性,灵验缓解医疗和科研的矛盾,保证临床推行质料。”王立丰说。
计策保障要抓续
“从永恒来看,改进药物的研发才略仍然是企业中枢竞争力所在。”中国工程院院士、中科院上海药物盘问所学术委员会主任丁健在经受经济日报记者采访时说,作念好新药,光靠企业和科学家不能,细密的计策环境至关弱点。
效果最为较着的即是药品上市许可抓有东谈主轨制的调动。2015年开动实施的为期3年的《药品上市许可抓有东谈主轨制试点决策》明确建议,药品研发机构或科研东谈主员取得药品上市许可及药品批准文号的,不错成为抓有东谈主。这一计策明确了药品时间的领有者不错抓有批准文号,照章享有药品上市后的市集答复。
以醋酸卡泊芬净、吉非替尼为例,若聘请将时间转让给药品坐褥企业,时间转让费分手为1000万元、5000万元,而上市后年销售额分手为4000万元、1亿元,药品时间领有者抓有批准文号带来的市集答复大大高于时间转让获益。
焦红暗示,抓有东谈主轨制的实施省俭了新药创制的资金老本和时辰老本。研发主体得到市集答复后将抓续增多研发进入,促使科技终局革新,抓续带动企业竞争力的进步以及作事、消费、税收的增多,使得医药产业改进发展活力得到进一步引发。据统计,2017年,试点区域新药文牍量为734件,同比增长31.5%。其中,化学药品改进药肯求334件,同比增长24.2%;改进生物成品肯求90件,同比增长109.3%。
为了抓续推动新药研发活力,国度药监局日前已向天下东谈主大常委会作念《对于延伸授权国务院在部分地点开展药品上市许可抓有东谈主轨制试点期限的决定(草案)的阐扬》,拟将试点期限延伸至修改完善后的药品不息法实施之日。
丝袜美腿qvod王立丰流露,为得志临床用药需求,促进和推动医药企业加大研发进入,下一步,国度药监局一方面还将调度入口化学药品注册历练花式,将统共入口化学药品上市前注册历练调度为上市后监督抽样,加速境外新药上市程度;另一方面哥哥啪,还将实施药品专利贯穿和专利期限赔偿轨制,促使改进者具有合理的预期获益,加强常识产权保护,为药物研发改进营造细密计策环境,让更多改进终局惠及雄伟患者。业内大家也暗示,频年来,在药审更正等一系列计策赞成下,新药研发进入新时间,改进药正在崛起,肯定将来几年,国内改进药神志将会有较大改不雅。(记者 吉蕾蕾)